Практическая работа 5 ГДЗ Еремин Кузьменко 8 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Еремин, Кузьменко 8 класс, Просвещение:
Практическая работа 5
Экспериментальное решение задач по теме
«Генетические связи между классами неорганических соединений»
Реактивы: медь (стружка), железо (стружка, гвоздь), оксид магния, соляная кислота, растворы лакмуса, фенолфталеина, серной и азотной кислот, гидроксидов натрия, калия и кальция, карбоната натрия, хлоридов натрия, кальция и бария, сульфатов натрия, магния и меди(ІІ).
Оборудование: пробирки, штатив для пробирок, спиртовка, спички, держатель для пробирок.
1. Вам выдана смесь медных и железных стружек. Выделите из неё медные стружки химическим способом. Запишите наблюдения в тетрадь. Составьте уравнение реакции.
2. В трёх пробирках без этикеток находятся растворы серной кислоты, гидроксида калия и хлорида натрия.
Определите химическим путём, в какой пробирке находится каждый реактив. Напишите уравнения реакций.
3. В двух пробирках без этикеток находятся растворы хлорида натрия и карбоната натрия. Прилейте к ним соляную кислоту. Что наблюдаете? В какой из пробирок находится карбонат натрия? Напишите уравнение реакции.
4. Докажите опытным путём, что выданное вам вещество — гидроксид кальция — является основанием. Напишите уравнение реакции.
5. Докажите опытным путём, что оксид магния относится к основным оксидам. Напишите уравнение реакции.
6. При медленном окислении железа на влажном воздухе образуется ржавчина, которую упрощённо можно считать гидроксидом железа(Ш). Очистите железный гвоздь от ржавчины химическим способом. Напишите уравнение реакции.
7. Получите из раствора сульфата меди(ІІ) оксид меди(ІІ). Напишите уравнения реакций.
8. Исходя из оксида магния получите сульфат магния. Напишите уравнение реакции.
9. В пяти пронумерованных пробирках без этикеток находятся растворы: хлорида кальция, хлорида натрия, гидроксида бария, серной кислоты, гидроксида калия (вариант I); гидроксида кальция, сульфата натрия, хлорида бария, азотной кислоты, гидроксида натрия (вариант II). Из каждой пробирки отлейте по две порции раствора. К первой порции каждого вещества добавьте несколько капель лакмуса. Что наблюдаете? К следующей порции каждого раствора прилейте раствор соды — карбоната натрия. По результатам наблюдений заполните таблицу 20 и сделайте вывод о том, в какой пробирке находится каждый раствор. Напишите уравнения реакций.
1. При добавлении к смеси медных и железных стружек соляной кислоты в ней растворяются только железные стружки, т.к. железо стоит левее водорода в ряду активности металлов:
Fe + 2HCl > FeCl2 + H2^
При этом наблюдается выделение пузырьков газа.
Медь в кислоте не растворяется, т.к. располагается правее водорода в ряду активности металлов.
2. В каждую пробирку необходимо добавить индикатор лакмус.
Если лакмус изменил окраску на красную – в пробирке серная кислота H2SO4 (потому что она дает кислую среду).
Если лакмус изменил окраску на синюю – в пробирке гидроксид калия KOH (потому что он дает щелочную среду).
Если лакмус не изменил окраску и остался фиолетовым – в пробирке хлорид натрия NaCl, который дает нейтральную среду.
3. При добавлении в пробирку с хлоридом натрия NaCl соляной кислоты изменений не наблюдается, потому что реакции не происходит.
При добавлении в пробирку с карбонатом натрия соляной кислоты наблюдается выделение пузырьков газа:
Na2CO3 + 2HCl > 2NaCl + H2O + CO2^
4. Основания должны реагировать с кислотными оксидами и кислотами. Поэтому при пропускании через раствор гидроксида кальция углекислого газа будет наблюдаться помутнение раствора:
Ca(OH)2 + CO2 > CaCO3v + H2O
При добавлении к гидроксиду кальция индикатора лакмуса он синеет – признак щелочной среды. Если прилить к этому раствору серную кислоту, лакмус снова станет фиолетовым, потому что протекает реакция нейтрализации:
Ca(OH)2 + H2SO4 > CaSO4 + 2H2O
Таким образом, Ca(OH)2 реагирует с кислотным оксидом и кислотой, поэтому является основанием.
5. Основные оксиды реагируют с кислотами.
При добавлении к оксиду магния серной кислоты он растворяется:
MgO + H2SO4 > MgSO4 + H2O
Таким образом, MgO является основным оксидом.
6. Ржавчина – гидроксид железа (III), как и любое основание, он будет реагировать с кислотой, поэтому его можно удалить с гвоздя, подействовав раствором соляной кислоты:
Fe(OH)3 + 3HCl > FeCl3 + 3H2O
7. К раствору сульфата меди (II) добавляют щелочь до выпадения синего осадка:
CuSO4 + 2NaOH > Na2SO4 + Cu(OH)2v
Осадок отделяют, переносят в пробирку и нагревают до его почернения – образуется оксид меди (II):
Cu(OH)2 > CuO + H2O
8. Сульфат магния получают растворением оксида магния в серной кислоте:
MgO + H2SO4 > MgSO4 + H2O
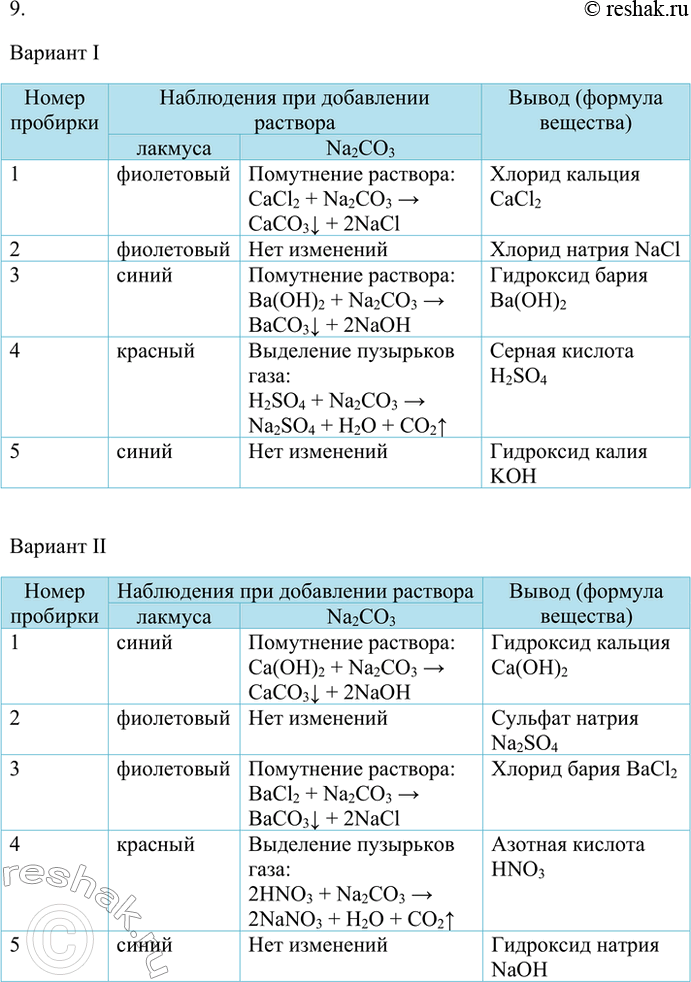
9.
Вариант I
Номер пробирки
Наблюдения при добавлении раствора
лакмуса
фиолетовый
фиолетовый
синий
красный
синий
Na2CO3
Помутнение раствора:
CaCl2 + Na2CO3 > CaCO3v + 2NaCl
Нет изменений
Помутнение раствора:
Ba(OH)2 + Na2CO3 > BaCO3v + 2NaOH
Выделение пузырьков газа:
H2SO4 + Na2CO3 > Na2SO4 + H2O + CO2^
Нет изменений
Вывод (формула вещества)
Хлорид кальция CaCl2
Хлорид натрия NaCl
Гидроксид бария Ba(OH)2
Серная кислота H2SO4
Гидроксид калия KOH
Вариант II
Номер пробирки
Наблюдения при добавлении раствора
лакмуса
синий
фиолетовый
фиолетовый
красный
синий
Na2CO3
Помутнение раствора:
Ca(OH)2 + Na2CO3 > CaCO3v + 2NaOH
Нет изменений
Помутнение раствора:
BaCl2 + Na2CO3 > BaCO3v + 2NaCl
Выделение пузырьков газа:
2HNO3 + Na2CO3 > 2NaNO3 + H2O + CO2^
Нет изменений
Вывод (формула вещества)
Гидроксид кальция Ca(OH)2
Сульфат натрия Na2SO4
Хлорид бария BaCl2
Азотная кислота HNO3
Гидроксид натрия NaOH
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением





